研究内容RESEARCH
最近の研究について
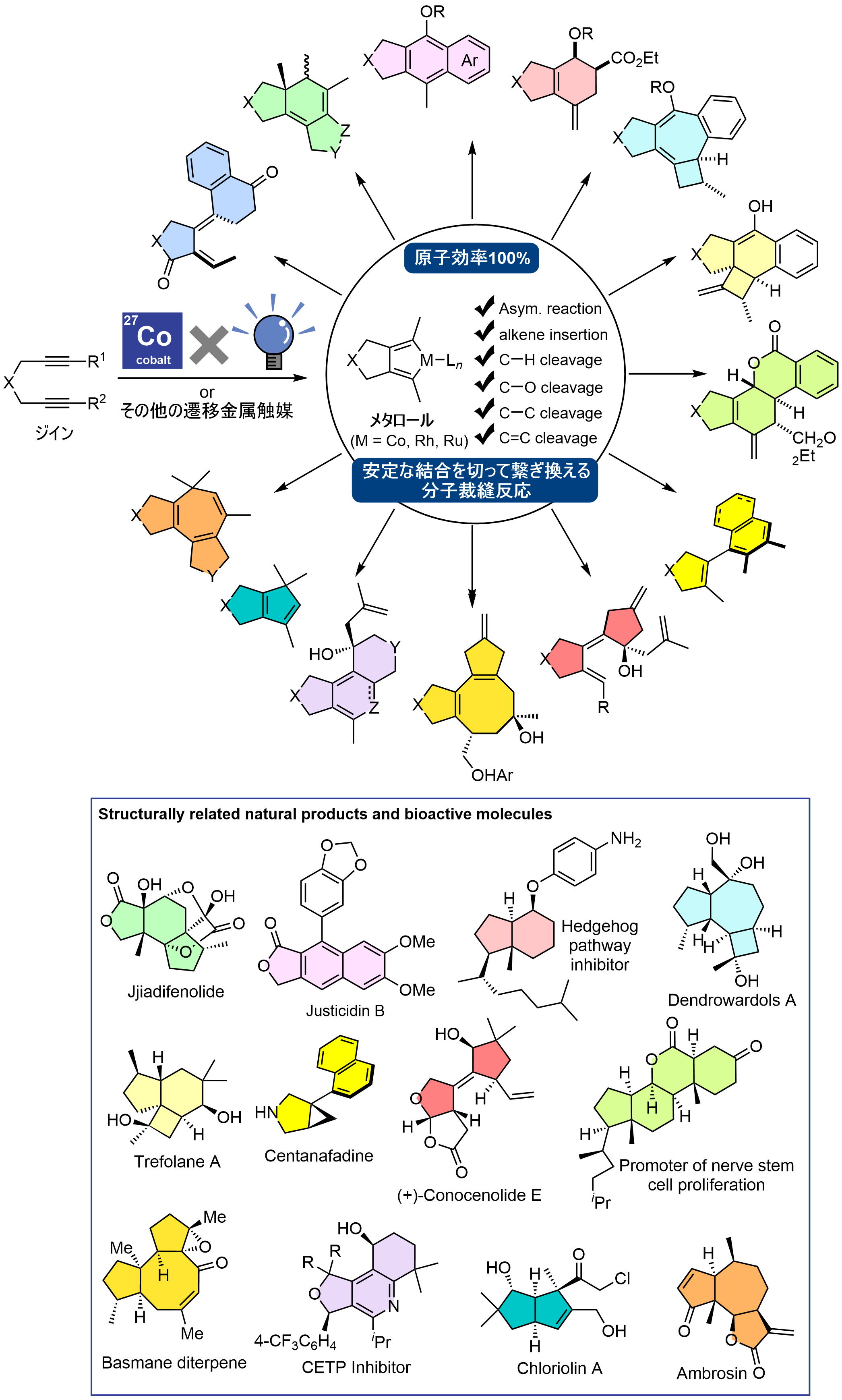
■メタロールの形成を起点とする分子裁縫反応
アルキンを分子内に2つもつ1,6-ジインは、様々な遷移金属触媒と反応し、メタロールと呼ばれる環状中間体を与えます。私たちは、メタロールの反応性に着目し、安定な炭素−水素結合や炭素−炭素結合を含む様々な結合を選択的に活性化できることを発見しています。特に、光エネルギーを駆動力とするコバルト触媒を用いる反応開発に力を入れて研究を進めており、これまでに、1,6-ジインを含む鎖状の基質から、天然物や生物活性物質にもみられる様々な環状骨格を一挙に構築することに成功しています。一連の反応は、結合を切って繋ぎ変えているだけですから、廃棄物も少なくて済みます。
関連文献
(1) T. Yasui, T. Kikuchi, Y. Yamamoto, Chem. Commun. 2020, 56, 12865.
(2) T. Yasui, Y. Nakazato, K. Kurisaki, Y. Yamamoto, Adv. Synth. Catal. 2021, 363, 4182.
(3) T. Yasui, R. Tatsumi, Y. Yamamoto, ACS Catal. 2021, 11, 9479.
(4) T. Yasui, K. Yamada, R. Tatsumi, Y. Yamamoto, ACS Catal. 2021, 11, 11716.
(5) T. Kikuchi, T. Yasui, Y. Yamamoto, ACS Catal. 2023, 13, 9656.
(6) K. Yamada, N. Koga, T. Yasui, Y. Yamamoto, ACS Catal. 2024, 14, 2049
(7) T. Yasui, Y. Yamamoto, ChemCatChem. 2024, 16, e202400488.
(8) K. Yamada, R. Hashiyama, T. Yasui, Y. Yamamoto, ACS Catal. 2025, 15, 3860.
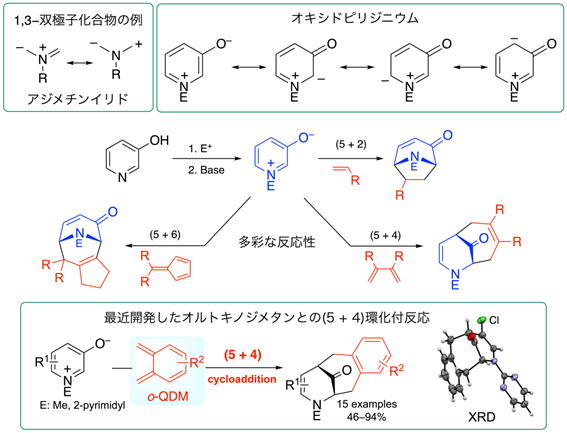
■オキシドピリジニウムの環化付加反応
1,3-双極子化合物は、アルケンと(3 + 2)環化付加反応して複素環化合物を与えます。オキシドピリジニウムは、1,3-双極子化合物に似たベタイン構造をもちますが、電荷が六員環上に非局在化しているため、多彩な環化付加反応性を示します。分子設計化学分野では、オキシドピリジニウムの反応性に着目し、実験と理論計算を融合した研究により、新しい環化反応の開発や、架橋構造をもつ新規複素環化合物の合成を進めています。
関連文献
(1) Y. Yamamoto, Y. Shizume, S. Tazawa, T. Yasui, J. Org. Chem. 2023, 88, 3193.
(2) Y. Yamamoto, S. Tazawa, R. Tadano, T. Yasui, Chem. Asian J. 2023, 18, e202300211.
(3) Y. Yamamoto, Y. Ide, T. Yasui, Org. Lett. 2025, 27, 63.
(4) Y. Yamamoto, Org. Chem. Front. 2025, 12, 3493.
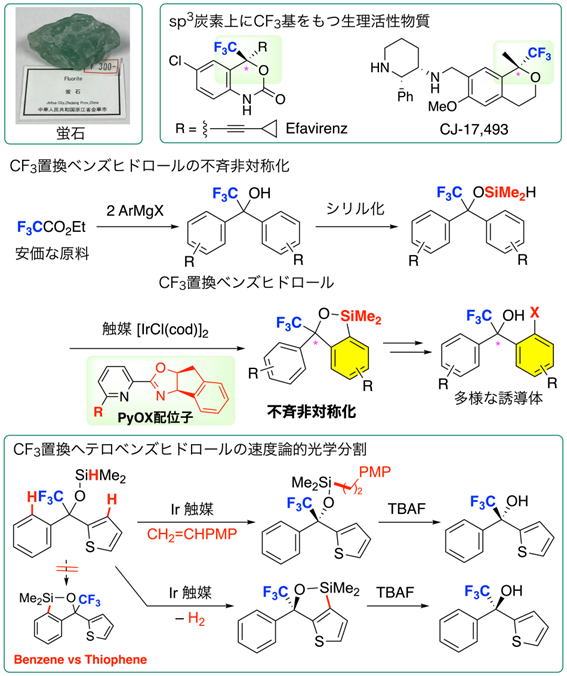
■含フッ素化合物の不斉合成
医薬品にフッ素を導入すると、脂溶性や代謝安定性といった性質を改善することができるため、現在上市されている医薬品の約30%にフッ素が含まれています。フッ素は地殻中で13番目に多い元素ですが(塩素は18番目)、主に蛍石(CaF2)、フッ素燐灰石(Ca5(PO4)3F)、氷晶石(Na3AlF6)といった水に溶けない鉱物に含まれるため、生物圏には含フッ素化合物はほぼ存在しません。したがって、化学合成によって含フッ素化合物を供給する必要があります。しかし、直接フッ素を導入する手法には、過酷な反応条件や危険な試薬を用いる必要があり、比較的単純な含フッ素化合物からより複雑な生理活性物質を合成する手法(ビルディングブロック法)が開発されてきましたが、含フッ素化合物の不斉合成、特にフルオロアルキル基が置換したsp3炭素のエナンチオ選択的な構築は今日でも極めて困難です。
そこで、単純な含フッ素化合物をエナンチオ選択的な分子変換によって、光学活性含フッ素化合物を効率的に合成する手法を開発しました。トリフルオロメチル基の置換したベンズヒドロールの水酸基にヒドロシリル基を導入した後、光学活性なイリジウム触媒を用いて、2つのベンゼン環の一方の炭素?水素結合を脱水素シリル化することで非対称化して、メソ体から光学活性体へと変換することに成功しました(不斉非対称化)。光学活性配位子としては、インダン骨格を含むピリジンオキサゾリン(PyOX)が最適であり、通常の脱水素シリル化反応に必要とされる水素捕捉剤であるアルケンが不要であることを見出しました。この手法をさらに拡張して、複素5員環を含むヘテロベンズヒドロールの速度論的光学分割にも成功しています。この際、ベンゼン環よりも複素5員環で脱水素シリル化が選択的に進行することを見出しています。
関連文献
(1) Y. Yamamoto, R. Tadano, T. Yasui, JACS Au 2024, 4, 807.
(2) R. Tadano, T. Yasui, Y. Yamamoto, Org. Chem. Front. In press.
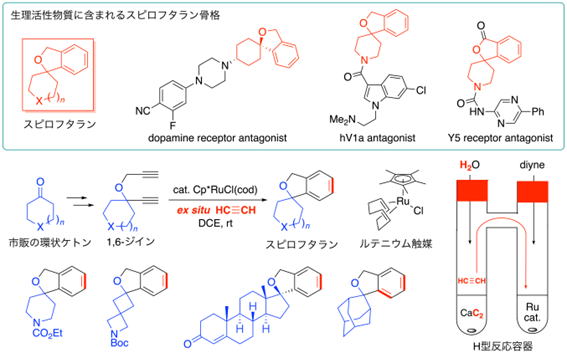
■カルシウムカーバイドをアセチレン源とする[2 + 2 + 2]環化付加反応
1836年にイギリスのEdmund Davyは、金属カリウムを単離するために炭酸カルシウムと炭素を高温で加熱し現在カリウムカーバイド(K2C2)として知られている物質を生成しました。この物質に水を作用させると空気中で燃焼する炭素と水素から成る気体が発生することを発見しました。1860年になってフランスのMercellin
Pierre Eugene Berthelotによってこの気体が再発見され、「アセチレン」と命名されました。1867年Berthelotはさらに、アセチレンを400℃以上に加熱するとベンゼンが生じることも発見しています。
アセチレンの発見に先立ち、1825年Michael Faradayは、魚の油から現在ベンゼンとして知られている物質を初めて単離しています。1965年Friedrich
August Kekuleは、現在知られているベンゼンの構造を提唱しました。第二次世界大戦中のドイツBASF社においてアセチレンの化学を研究していたWalter
Reppeは、1948年にニッケルカーバイドがアセチレンの環化四量化を触媒し、シクロオクタテトラエンが生じることを報告しました。Reppeはさらに、Ni(CO)2(PPh)3を触媒とするとアセチレンの環化三量化が進行してベンゼンが生じることも報告しています。遷移金属錯体を触媒とするアセチレンの環化三量化反応は、Reppe反応と呼ばれることがあります。この様に、カーバイドとアセチレン、及び、ベンゼンには密接な関係があります。
カルシウムカーバイドは水と反応してアセチレンを生じるため、アセチレンランプ等に用いられていましたが、石油化学工業が盛んになる以前の日本では、カルシウムカーバイドから発生するアセチレンを用いたカーバイド工業が発展しました。カルシウムカーバイドは安価なだけでなく、サステナブルな炭素源としても近年注目を集めており、精密有機合成への応用が進められています(V. P. Ananikov, et al., ChemSusChem 2019, 12, 1483; Eur. J. Org. Chem. 2021, 43)。
最近我々は、H型の反応容器を用いてカルシウムカーバイドと水から発生させたアセチレンガスを、直接ルテニウム触媒[2 + 2 + 2]環化付加に用いる方法を報告しました。この報告では、市販の環状ケトンから合成した1,6-ジインをアセチレンと反応させ、スピロ環状化合物を効率良く合成しています。スピロ環構造は、2つの環骨格が1つの原子を共有して結びついており、分子に3次元性を付与することから、生理活性物質の活性増強に寄与します。今回開発されたルテニウム触媒法は、生理活性化合物に応用可能なスピロフタラン骨格の効率的構築を可能にしました。
関連文献
Y. Yamamoto, K. Yoshimura, T. Yasui, J. Org. Chem. 2025, 90, 5695.
■C−H活性化を起点とする直接的官能基化反応
遍在するC−H結合の中から狙ったC−H結合を直接官能基化する分子変換法の開発は、合成プロセスの効率化につながるため重要視されています。安定なC−H結合も、遷移金属触媒を利用することで直接変換することができます。私たちは、この方法を活用し、医薬品などにみられる4-アミノ-2-キノロンを中心とする様々な芳香族化合物とアルキンおよびアルケンのカップリング反応を開発しています。理論計算やX線結晶構造解析などを通じて、これまで未解明であった詳細な反応機構を明らかにするとともに、導き出された原理に基づく新しい反応開発も行っています。
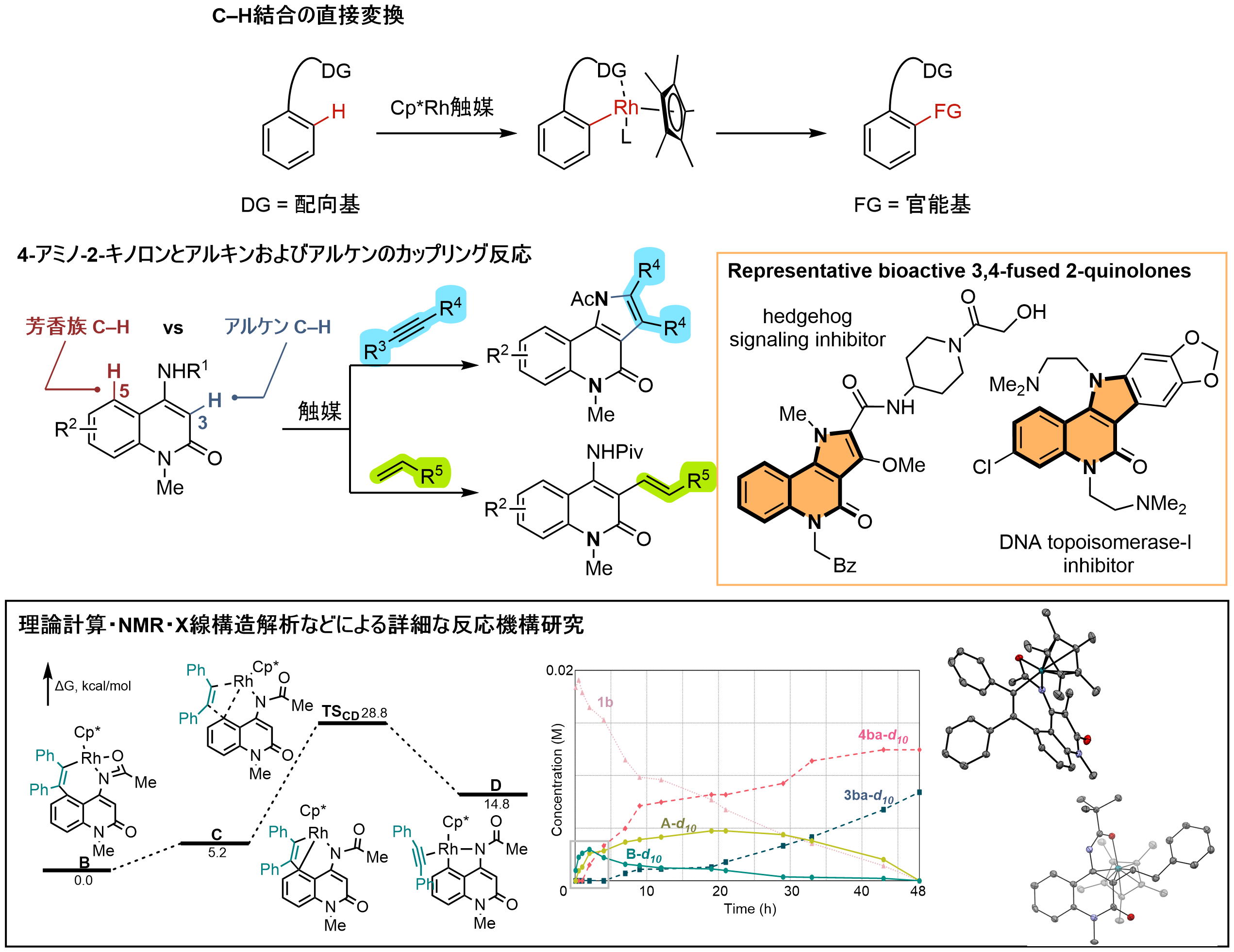
関連文献
(1) T. Yasui, S. Tanabe, T. Masueda, Y. Yamamoto, Synthesis 2023, 55, 1207.
(2) N. Hirako, T. Yasui, Y. Yamamoto, Chem. Sci. 2023, 14, 10971.
(3) N. Hirako, I. Takayanagi, D. Hirayama, T. Yasui, Y. Yamamoto, ACS Catal. 2025, 15, 10459.
このページの先頭へ
バナースペース
分子設計化学
〒464-8601
名古屋市千種区不老町
TEL 052-747-6800, 6801
FAX 052-747-6800, 6801