Cellular Biochemistry Laboratory, Graduate school of Pharmaceutical Sciences, Nagoya University
研究内容RESEARCH
高等動物における翻訳後修飾反応の一つであるタンパク質架橋接着反応を中心として研究を進めています。
この反応の生理的・病理的役割を明らかにすることを目的に、主に以下のテーマについて研究を行ってきました。
→ <詳細はこちら:タンパク質が接着する反応とは?>
生命農学研究科に所属していた頃から、この酵素を対象に ①酵素の組換えタンパク質や特異的抗体の作製、②哺乳類での組織発現分布や様々な生物(マウス・メダカ・真正粘菌)での発現分布と性状、③高反応性基質ペプチド配列の確立、④標識基質ペプチドを用いた酵素活性の可視化と基質候補の同定、といった研究を進めてきました。しかし最近はタンパク質架橋化の研究に加えて、研究対象として扱ってきた皮膚表皮形成、線維症、血液凝固などの生命現象そのものについても、分子細胞生物学・タンパク質生化学の技術で新しい知見や技術を得るべく展開しています。またマウスやメダカを疾患モデル生物として確立し、解析することも行っています。
たった一つの酵素に対する研究と思うかもしれませんが、この酵素は架橋接着活性以外にもGTPase活性、ジスルフィドイソメラーゼ活性、細胞接着因子間の結合活性、リン酸化活性など 一つの酵素がタンパク質修飾反応に関わる多彩な活性を示すことにより、実に多くの生理的・病理的作用につながるシグナル伝達機構に影響を持っています。さらに、これらの活性が影響を与える基質タンパク質については、発現する臓器・細胞・生体環境の違いにより異なり、多彩な標的基質及びこれに関連する因子が研究対象となります。
このため当研究室での研究を進めるにあたっては、細胞生化学・分子細胞生物学・疾患生物学などの多く分野の包括的な知識・技能を習得する必要があり、積極的に他領域について学ぶことが重要です。
皮膚形成に関する研究 -きめ細やかな皮膚の形成はどのような制御を受けている?ー
「皮膚表皮におけるタンパク質架橋反応の役割と空気暴露による表皮分化促進機構の解明」
~ 十分なバリア機能を有するための表皮分化はどう達成されるか? ~
皮膚表皮が一定の硬度を保って、水分保持や外界からの刺激に対処できるのは、トランスグルタミナーゼが、表皮内のタンパク質を架橋化し、cornified envelopeという防御壁を表皮細胞の膜に作るからです。これまで私たちは、皮膚(表皮)のトランスグルタミナーゼがどのように働いているかを明らかにしてきました。
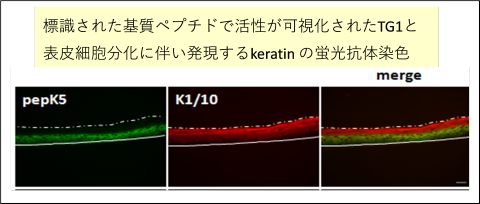
皮膚表皮にはトランスグルタミナーゼが少なくとも3種類(TG1, TG3, TG5)存在しています。これらがどのように役割分担をしながら表皮細胞内のタンパク質を架橋接着するのか、基質タンパク質に対する反応の違いを明らかにすると共に上に述べた高反応性基質配列を用いて、皮膚表皮の酵素活性を視覚化することを行っています。
すでに私たちは、皮膚表皮形成に関わるTG1 (FEBS J 2008) と TG3 (FEBS J 2010)、さらに表皮に存在することを新たに見出した TG6 (FEBS J 2013) の高反応性基質配列を明らかにしています。
これらを用いて、それぞれの酵素がどのようなタンパク質を架橋化して丈夫な表皮形成に貢献していくのか、
架橋される基質探索を行っています (BBRC 2016)。
得られた基質タンパク質情報を基に、架橋される基質とその順序(様式)、皮膚形成におけるTGase の発現パターンについて明らかにしていきたいと考えています。
また、より実際の皮膚表皮を模倣できる立体培養細胞系を用いて、各TGaseの発現や活性上昇の過程、遺伝子ノックダウンによる表皮形成への評価を調べました(FEBS J 2019、Anal Biochem 2020)。
<共同研究のシーズ>
TG1(ポリクロ―ナル抗体)やTG3(モノクロ―ナル抗体)を供与できます。また、TG1, TG3など表皮(上皮)やの酵素活性を測定できるアッセイ系および高反応性基質配列に基づく基質ペプチドを使った酵素の高感度な可視化技術の提供。
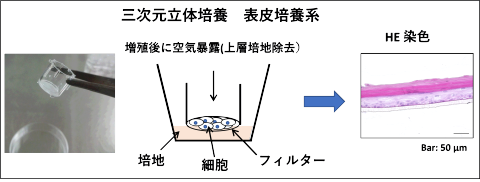
「皮膚表皮立体培養系に着眼した、空気暴露による表皮形成メカニズムの解明と羊水に含まれる表皮形成因子の探索」
これまでにトランスグルタミナーゼの表皮細胞での機能解析を取扱う中で表皮形成を再現できる、3次元立体培養システムを用いてきました(上図)。これはヒトの初代培養細胞をフィルター上で「二重いかだ培養」して増殖させたのち、高いカルシウム濃度の分化用培地を用いたうえで、空気暴露(フィルター上の培地を除去)するという特殊な操作をすれば、表皮が多層化し脱核して正常な表皮に近い形での分化増殖が達成されるものです。この技術自体は今から20-30年前から利用されてきたものですが、我々はこの空気暴露という特異な操作がなぜ分化に必要なのかという点に興味を持ちました。そこで、空気暴露をしないで培養を続けた場合の表皮培養細胞を解析するとともに、空気暴露の有無で起こる遺伝子発現パターンの比較解析を行いました。
その結果、幾つかのカテゴリーに属する遺伝子群の変化が見られました。その中でも顕著に差異がみられた「低酸素応答(HIF: Hypoxia inducing
factor)」の分化促進への関連に特に注目して現在研究を進めています。HIFはノーベル賞の受賞対象となった重要な因子であり、これが表皮分化とどのように関わるのかを中心に遺伝子・タンパク質レベルでの解析を行っています。また、この現象から着想した、羊水からの表皮細胞分化を調節する因子の探索同定も進めています(Arch Biochem Biophys 2021)。 なお本研究は令和2年度(~令和4年度)の科研費である挑戦的研究(開拓)に採択して頂きました。
共同研究先:
名古屋大学フィールド科学研究センター(農場)
名古屋大学生命農学研究科 (村井 篤 准教授)
名古屋大学大学院医学系研究科(皮膚科学 秋山 真志 教授)
松本歯科大学歯学部(長谷川 博雅 教授)
組織線維化に関する研究 ー 肝硬変や腎炎などで組織がどのように硬くなる? ー
「この架橋化酵素は多くの病気の発症の原因になります! いったいどのように疾患に関わるのだろう?」
生理的反応である血液の凝固、皮膚形成、死細胞の除去だけでなく、トランスグルタミナーゼは多くの疾患(肝腎疾患、皮膚疾患、神経変性疾患、糖尿病、癌、血栓形成、自己免疫疾患など)発症の原因になります(Cell Death Dis. 2016、Cells 2021)。
今後も対象疾患を拡大していく予定ではありますが、現在は肝硬変・腎不全・肺線維症に関わる「組織線維化」に注目し、
各種の疾患動物モデル(肝線維化、アルコール性・非アルコール性脂肪性肝炎、糖尿病性腎症、腎線維化、急性腎障害、特発性肺線維症、腹膜線維化)を作製して発症原因に繋がる分子メカニズムについて解析しています(Sci Rep 2017、
Sci Rep 2018、Anal Biochem 2020、Am J Respir Cell Mol Biol 2021:名古屋大学プレスリリース)。
また、動物個体を用いた解析と並行して、現在は詳細な疾患に関わるメカニズム解析を目的として種々の細胞モデル(細胞死、組織・骨髄由来マクロファージの分化能、線維形成細胞の活性化)を用いた研究も進めています。次世代シーケンス解析、プロテオミクス、誘導型や組織・細胞種特異的な遺伝子変異マウスの作製、ウイルスベクターなど様々な技術を用いて、疾患分子機構の解明に取り組んでいます。
すでに私たちは上記の疾患において機能未知の多くの候補基質タンパク質群を同定しており、今後は基質タンパク質の機能解析を進めることにより、異常な架橋形成に起因する疾患の病態機序の解明や予防・治療法、疾患マーカーの開発などに繋げていきたいと考えています。
共同研究先:
名古屋大学医学部
藤田保健衛生大学医学部
名城大学薬学部
愛知医科大学医学部
ドイツ Max Plank研究所、病院、製薬会社など
各種疾患の治療・予防を見据えた創薬的研究
~ ケミカルバイオロジーによる作用機序の解析や質量分析による標的探索を利用した創薬的研究 ~
「標的特異的に働く低分子化合物を利用して、各種疾患に対する新規治療・予防法の開発を目指す」
ケミカルバイオロジーとは化学をツールとして生物機能の解明を行う学問です。
タンパク質架橋化酵素を含む様々な作用標的因子の立体構造や活性に対するアプローチにより、低分子化合物を用いた創薬的研究を行っています。
作用機序が不明な化合物に対しては作用標的タンパク質の取得のため、構造活性相関に基づき、近傍の因子と共有結合する光反応活性基を付加した化合物を作製して実験をしています。研究対象の標的化合物に対して、さらにアジドの付加体を合成し、クリックケミストリーを利用した各種標識反応により化合物に結合する因子や近傍の因子の精製を経て、質量分析による網羅的な同定を行っています。この手法により、細胞内で結合性が比較的弱い化合物に対しても標的タンパク質を取得することが可能となります。
これらの研究のスムーズな遂行には、化合物の作製にあたる有機合成化学者との密な連携が必須であるため、同研究科の有機合成化学者との共同研究により実施しています。
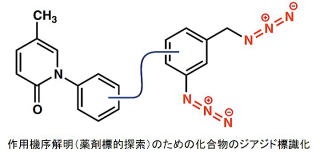
現在、既存の薬物にはない有用な作用を示す低分子化合物を既に取得しており、今後創薬シーズとしての可能性を検討中です。
共同研究先:
創薬科学研究科 天然物化学分野
製薬会社など
メダカを用いたトランスグルタミナーゼ関連因子の遺伝子変異個体の作製と機能解析
~ ゲノム編集による疾患phenocopyの確立 ~
メダカは近年、ゼブラフィッシュと並んで世界レベルでモデル生物として用いられており、その対象領域も従来の発生分化・生理機能解析から創薬スクリーニングの可能性も見据えた医薬関係へと広がりつつあります(名大はメダカ研究のメッカです)。
魚類であるメダカにもトランスグルタミナーゼの相同遺伝子群(対応するよく似た遺伝子)が存在します。哺乳類で役割が明確な、血液凝固(Factor XIII)、表皮形成(TG1)、組織型(TG2)に相当する各酵素について、私たちはこれらのメダカ酵素に対する抗体や組換えタンパク質を作製して性質を明らかにしました。
(PLOS One 2015, Anal Biochem 2020 他)。
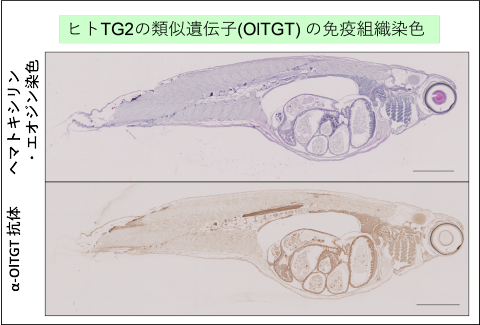
「ゲノム編集」という最先端の遺伝子操作技術を用いて、その酵素の遺伝子を変異させたメダカの作製にも成功しています。(Biosci Biotechnol Biochem 2018,
J Biochem 2020, FEBS J. 2017)。
最近ではトランスグルタミナーゼ類似遺伝子だけでなく、血液凝固因子としてのトロンビン、フィブリノーゲンも対象にしています。血液凝固に関わるトランスグルタミナーゼ(Factor XIII)は、不活性な前駆体で合成されて、トロンビンによる切断で活性化されます。同時にトロンビンはフィブリノーゲンをフィブリンへと限定分解し、その分解による構造変化でポリマー化(多量体化)します。活性化したFXIIIはこの多量体フィブリンに架橋化修飾をすることでより安定な凝固産物が形成されます。従って、この三者は綿密に連携しています(図)。
私たちは3つのいずれについても遺伝子欠損体を得ており、血液凝固不全のモデルを獲得しています (Biosci Biotechnol Biochem 2021)。同時にメダカにおいてフィブリンやトロンビンが、血液凝固に関わる肝臓組織だけでなく、他組織にも発現することを見出しており、生理的意義の解明も目指しています。解析には組織特異的な遺伝子欠損(他組織での欠損によりどのような表現型が現れるのか)個体の作製が有効ですが、特定の組織で遺伝子欠損や発現が制御できるシステムはの開発についてはメダカではまだ進んでいません。組織特異的な遺伝子欠損にはCre (Cre recombinase)-loxシステムが有用です。特定の組織で発現する何らかのタンパク質の遺伝子プロモーターを活用し、ゲノム編集技術を用いた遺伝子改変個体を作製するという戦略です。これまでに、肝臓特異的や表皮(上皮)特異的なCre発現を行えるメダカの開発に成功しています。これらのモデル生物を用いて、薬剤スクリーニング系の開発、未知の生理機能の解明や疾患状態の解析に用いられるメダカの確立を目指しています。
共同研究先:
名古屋大学生物機能利用開発研究センター(理学研究科)の橋本 寿史 博士
基礎生物学研究所(岡崎市:成瀬 清 特任教授、亀井 保博 特任准教授)
京都大学農学研究科 木下 政人 准教授
<提供可能なシーズ>
トロンビンなどの血液凝固因子、トランスグルタミナーゼ遺伝子が変異して異常が観察されるメダカの提供
(2020年現在:基礎生物学研究所に寄託)
タンパク質架橋接着酵素(トランスグルタミナーゼ)の高反応な最小基質配列
「酵素がタンパク質を接着させるために、どんな配列だったら基質になりやすいか?」
タンパク質であれば、何でもトランスグルタミナーゼの基質になり接着されるわけではありません。また反応において、基質タンパク質の中のグルタミン残基はどれでも反応に関わっているのではありません。
トランスグルタミナーゼがタンパク質を修飾しようとするときにはグルタミン残基について、何らかの反応に関わりやすいルール(制限)があるといわれています。周りの配列(一次構造)や立体構造が関わると考えられますが、酵素が発見されて以来、そのルールはあまり明らかではありませんでした。
当研究室ではランダムなペプチドを提示したファージディスプレイを用いた実験系を確立することに成功し、そのルールを明らかにしようとしています(杉村さん、J Biol Chem 2006, Arch Biochem Biophys 2008)。これらの配列を「のりづけ配列」として、機能を持つ蛋白質を方向性を制御して固定する応用研究も行いました(J Biotech 2007)。
→ <詳細はこちら:基質認識機構の解析>
トランスグルタミナーゼのアイソザイムは8種類ですが、それぞれに架橋する基質には好みがあります。そのような違いも、基質のグルタミン残基の周辺構造から生まれているとされています。
これまでの研究で、TG2 やFXIII の基質になるためのグルタミン残基周辺の配列には、一定のルールがあることを見出しています (Amino Acids 2009)。また、皮膚特異的なアイソザイムであるTG1 (FEBS J 2008) やTG3 (FEBS J 2010) についても高い反応性の基質配列を同定しました。
現在は他のアイソザイム(神経型TG6, 機能未知なTG7, 分泌腺型TG4) についても、解析を進めているところです。
このような基質配列は、いろいろな基礎研究や応用研究に役立てることができます。
この配列を利用して、これまでにアイソザイムを区別できる簡単で高感度なアッセイ系(測定系)をフランス・CovalAb 社 (CEO:Said El
Alaoui 博士)との共同研究で開発しました(TG2: Anal Biochem 2009, TG1 & FXIII: Anal Biochem 2009)。
また色々な培養細胞を使うことで、接着される基質タンパク質の探索も可能になりました。
これまではアイソザイム特異的に探すことは不可能でしたが、我々の得たペプチドを用いれば可能です。また、骨芽細胞を対象にして、こうした新しい基質探索系が確立できました。
<共同研究のシーズ>
我々が同定した、トランスグルタミナーゼ(TG2 および FXIII)の高い反応性配列は、様々な応用に可能性があります。酵素反応でタンパク質に接着されやすい、このような配列を導入することで、配向性をコントロールした固定化・新素材の開発を考えています。
また、これらは、蛋白固定化、またアイソザイム特異的なインヒビター(阻害剤)の開発にも貢献が期待できます。
特許取得:
「トランスグルタミナーゼ基質反応性を有するペプチド及びその利用」 特願2005-380040 人見 清隆, 杉村 昭禎, 牧 正敏(名古屋大学)
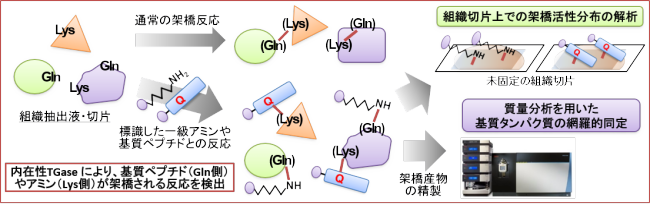
組織内トランスグルタミナーゼ活性の可視化
「この酵素の活性は体内でどんな分布をしているのだろう?」
上に述べた高反応性基質配列を用いると、組織や細胞の中に存在するトランスグルタミナーゼの活性を可視化することができました。初めに、皮膚表皮においてTG1 の表皮内の活性を示すことができ、その後、他の組織においても各TGase 活性を観察することが可能であることを示しました。
また、北海道大学皮膚科学の秋山真志教授(現在、名古屋大学医学部)との共同研究により、皮膚の病気の診断にも使えることが分かりました (Am J pathol 2009)。
鶴見大学の川本忠文先生との共同研究で、マウスの全組織切片を用いて、全体組織における活性の発現解析を行いました。
この成果は、マウスの全組織中のTG1、TG2 の活性分布状態を一気に明らかして、これまでにその存在が明らかでなかった組織にもTGase が働く可能性があることを示しました
(J Histochem Cytochem 2011)。このような新たな技術と発見は、2010年の国際学会(2010 Gordon Conference)でも注目されました。
今後は、in situ hybridization や抗体染色による発現パターン解析も行いながら、発生過程での活性の可視化、培養細胞レベルでの可視化に進めていきたいと考えています。
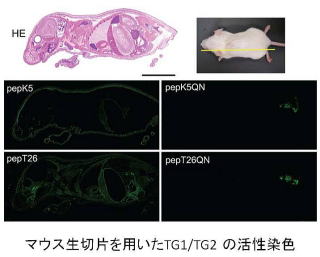
↓ 詳細はこちら

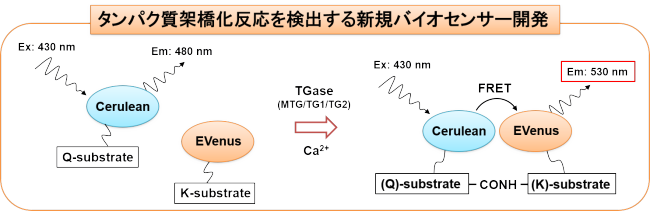
また最近は、生きた細胞・組織での同酵素活性のリアルタイム観察を目指し、FRET(蛍光共鳴エネルギー移動)という技術を応用した新しい活性測定プローブの開発を行っています (Amino acids 2017)。