Cellular Biochemistry Laboratory, Graduate school of Pharmaceutical Sciences, Nagoya University
トランスグルタミナーゼの高反応性配列の探索と活用
どんなタンパク質でもトランスグルタミナーゼの基質になっているわけではなく、特定のタンパク質が架橋されたり、一級アミンが導入されたりします。
また、基質の中にあるグルタミン残基(Gln, Q)の全てが反応に関わるわけではありません。
つまり、トランスグルタミナーゼが反応をしかけるグルタミン残基には、何らかの(環境)条件があるのです。
(一方、リジン残基については、それほど制約がないとされています。しかし、我々も含め最近では一定の傾向はあるようです。)
一般の酵素ー基質の相互作用研究でも進められたように、周囲の分子構造(配列や二次構造)がこれを決定していると考えられています。
例えば、トリプシンなら、リジンやアルギニンに隣接した残基との間が切断されます。これまでトランスグルタミナーゼには、そうした明確な基質認識のルールがほとんど見つかっていませんでした。
存在する8つのアイソザイムはそれぞれ基質とするタンパク質が異なっている場合もあるので、それぞれのアイソザイムについて何らかのグルタミン残基の認識の仕方の違いがあることも予想されます。
こうした基本的な酵素反応の情報は大変重要ですが、研究方法のむずかしさから、これまで後回しにされてきました。
我々は、ファージディスプレイ法という、ランダムにペプチドを提示してくれる実験系を用いてこの問題解決の方法を樹立しました。
現在までに、この手法を用いて Factor XIII、TG1, TG2, TG3, TG6, TG7 に関して「高反応性配列」を明らかにしました。
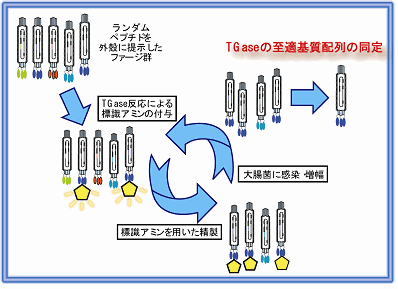
ファージディスプレイは、ファージの殻タンパク質の一部に、ランダムにペプチド配列が融合しているファージクローンが多数存在するものです。ファージのクローンがどのようなペプチドを提示しているのかは、そのファージのDNA配列(融合したペプチドに相当する場所)を読むことでわかります。
我々の方法では、ビオチン標識した一級アミンをファージ溶液とトランスグルタミナーゼの存在下で反応させます。多数のファージの提示した様々なペプチド配列の中には、グルタミン残基に一級アミンが酵素反応で取り込まれたものがあり、そうしたファージクローンをアビジンカラムで精製します。
ファージを溶出して増殖し、トランスグルタミナーゼによる標識一級アミンの取り込み、精製を繰り返していくことで、基質となる配列を提示しているファージクローンを収束させていきます。
このスクリーニングで得られる配列を、組換え蛋白質と融合させて発現精製し、実際に一級アミンの取り込み反応について高い反応性を示したものを選択しました。 配列に相当するペプチドを作製して、ペプチドレベルでも高い反応性とアイソザイム特異性を示すことを明らかにしました。
この方法は、あらゆるトランスグルタミナーゼの高反応性基質配列の同定に用いることが可能です。味の素株式会社ライフサイエンス研究所との共同で微生物(放線菌)由来のトランスグルタミナーゼの基質配列の道程も行いました(Archiv. Biophys. Biochem. 2008)。
また、このペプチド(高反応性基質配列)は、様々な応用が可能です。
酵素などの機能を持ったタンパク質に付加することで、これを固定化(固相にはリジンもしくは一級アミンを付加)しておき、酵素的に機能タンパク質を共有結合で結合できます。この反応の際には、機能性タンパク質の機能を発揮するのに障害を与えない領域にペプチド配列を付加することで、穏やかな酵素反応で固定化が可能です(J Biotechnol. 2007)
ペプチドのアイソザイム特異性を活用して、ビオチン標識ペプチドを用いた高感度なアッセイ系を確立しました(フランス Covalab 社との共同研究:Anal. Biochem. 2009 2報)。
さらに、得たペプチドを蛍光標識することで、活性を視覚化できることも示しました (FEBS J, 2008, 2010)。 最近の成果として、この方法を全マウスの組織切片を使って、見事に全ての組織での活性パターンを一挙に可視化することに成功しました(鶴見大学・川本忠文博士との共同研究, J. Histochem. Cytochem. 2011)。皮膚型アイソザイム(TGase 1) と、組織型 (TGase 2) のそれぞれに特異的な蛍光標識基質ペプチドを用いることで、その活性分布を明らかにしました。これまでに存在が見つけられなかった組織についても明らかにすることができました。この成果を元に、今後は発生段階に伴う活性パターンの変化、培養細胞内での活性の検出などを行っていく予定です。
つまり、トランスグルタミナーゼが反応をしかけるグルタミン残基には、何らかの(環境)条件があるのです。
(一方、リジン残基については、それほど制約がないとされています。しかし、我々も含め最近では一定の傾向はあるようです。)
一般の酵素ー基質の相互作用研究でも進められたように、周囲の分子構造(配列や二次構造)がこれを決定していると考えられています。
例えば、トリプシンなら、リジンやアルギニンに隣接した残基との間が切断されます。これまでトランスグルタミナーゼには、そうした明確な基質認識のルールがほとんど見つかっていませんでした。
存在する8つのアイソザイムはそれぞれ基質とするタンパク質が異なっている場合もあるので、それぞれのアイソザイムについて何らかのグルタミン残基の認識の仕方の違いがあることも予想されます。
こうした基本的な酵素反応の情報は大変重要ですが、研究方法のむずかしさから、これまで後回しにされてきました。
我々は、ファージディスプレイ法という、ランダムにペプチドを提示してくれる実験系を用いてこの問題解決の方法を樹立しました。
現在までに、この手法を用いて Factor XIII、TG1, TG2, TG3, TG6, TG7 に関して「高反応性配列」を明らかにしました。

基質探索法の原理(ファージディスプレイ)
トランスグルタミナーゼは、タンパク質どうしの架橋だけでなく、グルタミン残基に一級アミンを取り込む反応も触媒します。従ってリジン残基の代わりに、標識した一級アミンを用いると、グルタミン残基に、標識アミンが取り込まれます。ファージディスプレイは、ファージの殻タンパク質の一部に、ランダムにペプチド配列が融合しているファージクローンが多数存在するものです。ファージのクローンがどのようなペプチドを提示しているのかは、そのファージのDNA配列(融合したペプチドに相当する場所)を読むことでわかります。
我々の方法では、ビオチン標識した一級アミンをファージ溶液とトランスグルタミナーゼの存在下で反応させます。多数のファージの提示した様々なペプチド配列の中には、グルタミン残基に一級アミンが酵素反応で取り込まれたものがあり、そうしたファージクローンをアビジンカラムで精製します。
ファージを溶出して増殖し、トランスグルタミナーゼによる標識一級アミンの取り込み、精製を繰り返していくことで、基質となる配列を提示しているファージクローンを収束させていきます。
このスクリーニングで得られる配列を、組換え蛋白質と融合させて発現精製し、実際に一級アミンの取り込み反応について高い反応性を示したものを選択しました。 配列に相当するペプチドを作製して、ペプチドレベルでも高い反応性とアイソザイム特異性を示すことを明らかにしました。
この方法は、あらゆるトランスグルタミナーゼの高反応性基質配列の同定に用いることが可能です。味の素株式会社ライフサイエンス研究所との共同で微生物(放線菌)由来のトランスグルタミナーゼの基質配列の道程も行いました(Archiv. Biophys. Biochem. 2008)。
また、このペプチド(高反応性基質配列)は、様々な応用が可能です。
酵素などの機能を持ったタンパク質に付加することで、これを固定化(固相にはリジンもしくは一級アミンを付加)しておき、酵素的に機能タンパク質を共有結合で結合できます。この反応の際には、機能性タンパク質の機能を発揮するのに障害を与えない領域にペプチド配列を付加することで、穏やかな酵素反応で固定化が可能です(J Biotechnol. 2007)
ペプチドのアイソザイム特異性を活用して、ビオチン標識ペプチドを用いた高感度なアッセイ系を確立しました(フランス Covalab 社との共同研究:Anal. Biochem. 2009 2報)。
さらに、得たペプチドを蛍光標識することで、活性を視覚化できることも示しました (FEBS J, 2008, 2010)。 最近の成果として、この方法を全マウスの組織切片を使って、見事に全ての組織での活性パターンを一挙に可視化することに成功しました(鶴見大学・川本忠文博士との共同研究, J. Histochem. Cytochem. 2011)。皮膚型アイソザイム(TGase 1) と、組織型 (TGase 2) のそれぞれに特異的な蛍光標識基質ペプチドを用いることで、その活性分布を明らかにしました。これまでに存在が見つけられなかった組織についても明らかにすることができました。この成果を元に、今後は発生段階に伴う活性パターンの変化、培養細胞内での活性の検出などを行っていく予定です。