Cellular Biochemistry Laboratory, Graduate school of Pharmaceutical Sciences, Nagoya University
タンパク質が接着する反応とは?
私たちの体の中では、翻訳後修飾という出来上がったタンパク質がいろんな方法で短く切られたり(タンパク分解)、低分子が付与されたり(リン酸化・アセチル化)といったタンパク質に対する様々な修飾が起こりますが、タンパク質どうしが共有結合で接着(架橋)するというユニークな修飾反応があることをご存知ですか?
このようなタンパク分解の逆反応とも言える珍しい反応は、トランスグルタミナーゼ (Transglutaminase; TGase or TG) という名前の酵素ファミリー(複数種の酵素群)によって行われます。この酵素反応の生理的な意義(何のために存在しているのか)についてはまだまだ未知な点が多く残されています。ここではその反応と分かっている機能(役割)について紹介します。
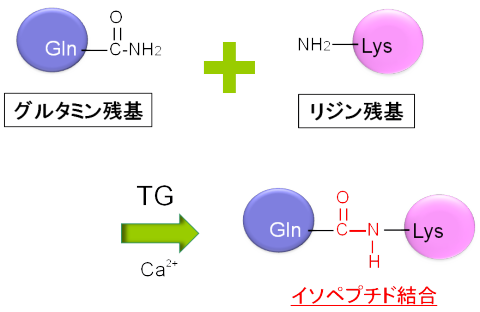
タンパク質のグルタミンというアミノ酸残基に、リジン残基のアミノ基がペプチド結合によって結ばれます(架橋反応)。架橋される基質は同じ場合(分子内架橋)や異なる場合(タンパク質間架橋)があります。また、リジン残基だけでなく、
一級アミンもグルタミンに結合します。
しかし体の中で何の制限も無く、このようなことが起こっては大変です。
この反応には適切なカルシウムイオンが必要で、カルシウムによる立体構造の変化
(TG2)やプロテアーゼなどにより少し分解されて形が変わる(TG3, FXIII)など、厳密なコントロール(活性制御機構)が知られています。
アイソザイムと言う言葉を知っていますか?
いわば酵素の「兄弟姉妹」のようなもので、触媒する反応形式は同じですが、
一次構造(アミノ酸配列)や存在する場所(組織分布)が異なるものをいいます。トランスグルタミナーゼはヒトの場合、8種類がこれまでに見つかっています。
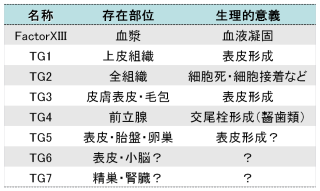
それぞれは以下のように、分子量(大きさ)、存在部位、役割が異なります。
これらのアイソザイムは、Factor XIII (血液凝固第13因子)以外は発見順に背番号がついています。また、赤血球には、バンド4.2と呼ばれる、酵素活性はないものの、形のよく似たタンパク質が存在しています。ヒト、マウスの遺伝子が明らかにされており、これらのTGaseが研究対象としてよく用いられています。哺乳動物にはおそらく全て同じようなアイソザイムが存在すると考えられています。
(右の表はヒトのトランスグルタミナーゼファミリー)
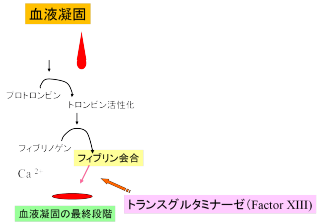
出血した時、血が固まってかさぶたになります。ここにトランスグルタミナーゼが働いています。 血液凝固は、血液の液体部分(血漿)の中にある、いくつかのタンパク質が形を変えて働き、最後の段階ではフィブリンと言うタンパク質が、重合化(たくさん集まること)して、不溶化します。フィブリンも初めはフィブリノーゲンという名前で溶けていますが、トロンビンと言う酵素で切断されて、これがトランスグルタミナーゼ(Factor XIII: 13番目に働くタンパク質なのでこう呼んでいます)によって架橋重合されます。
つまり、血液凝固の最後に登場して、血を固める。当然ながらこの酵素がおかしくなれば、様々な血液凝固傷害、流産(原因は不明)などが起こることが報告されています。
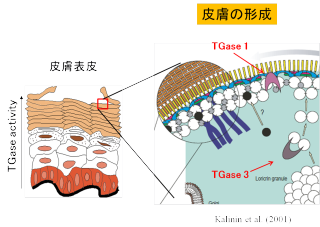
皮膚表皮形成(TG1, TG3, TG5, TG6?)
普段は感じませんが、我々の皮膚は外界からの刺激、つまり紫外線や物理的な力、さらには病原菌にも対処できるような丈夫なバリアとして働いています。 皮膚の表面は細胞が生命活動をやめていて、細胞の中のタンパク質が細胞膜周辺に固まって存在しています。これを角化といいます。
トランスグルタミナーゼは、表皮細胞が、皮膚の奥からできあがるにつれて、細胞の中にあるタンパク質を架橋重合化して、細胞膜に集め、裏打ちして、物理的にも化学的にも強力なバリアを作ることに役立っています。
右図では表皮細胞内の様々なタンパク質(構造タンパク質といいます)が、架橋重合されています。
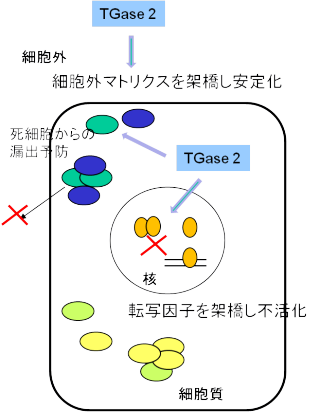
傷害の修復・細胞外マトリクスの強化・細胞死・死細胞の処理(TG2)
細胞は傷つくこともあり、寿命もあり、また突然に死ぬことがあります。 こうした傷を受けた細胞の細胞膜を修復することにも役立っています。また、死んだ細胞からの漏出物が悪影響を及ぼさないように、細胞内のタンパク質など構成成分を架橋重合化して、漏れを防いでいます。 細胞よってはその周辺に、細胞外マトリクス(コラーゲン、フィブロネクチン)を分泌して、他細胞との周りを埋めています。これをさらに強化するということに働いています。また、肝障害時の細胞死誘導やマクロファージという死んだ細胞を食べて処理(貪食)する細胞の機能にも関わっています。
神経疾患、自己免疫疾患にも関わっている まだ研究が進行中ですが、様々な神経疾患(アルツハイマー病など)の原因にも、このタンパク質接着架橋が絡んでいるのではないかと言われていて、いくつかの報告があります。神経細胞内で異常に架橋形成が起こって、タンパク質が細胞の中で固まり(不溶性沈着物)となって、有害になるという説が上げられています。 また、欧米諸国では、この酵素の働きが小麦タンパク質にアレルゲンとしての性質を与える(セリアック病)ことが知られており、多くの患者がいます。
このタンパク質同士の架橋化反応やそれを司る酵素は、無脊椎動物、植物や微生物など幅広い生物で存在します。遺伝子構造が明らかにされているものもあります。微生物(放線菌)の産生する、トランスグルタミナーゼはとても活性が安定であり、現在は食品の粘弾性の強化のために使われています(味の素株式会社より、「アクティバ」の商品名で市場に出ています)。
無脊椎動物では、昆虫(バッタ、ショウジョウバエ)、カブトガニ、ウニ、微生物でも細菌類で遺伝子クローニングが完了して構造が明らかになっています。ところが、無脊椎動物のトランスグルタミナーゼは上にあげたヒトやマウスのものとよく似ているのですが、微生物になると全く構造が違います。植物はまだよくわかっていません。しかし、我々は、原生生物(動植物、菌類のいずれにも属さない)の粘菌(真正粘菌)のトランスグルタミナーゼ遺伝子の解析に成功して、これが極めて動物のタイプに近いものであるという驚くべき結果を得ました。
ショウジョウバエ、ゼブラフィッシュ、ウニなどの発生学、形態形成の研究のモデル動物にも、高等動物と同じような構造をしたトランスグルタミナーゼが存在しています。今、このような動物をモデルにして、遺伝子をノックダウン(転写されなくする)した変異動物が作製され、そこからタンパク質架橋反応の意義を見出す、という研究が行われつつあります。
このようなタンパク分解の逆反応とも言える珍しい反応は、トランスグルタミナーゼ (Transglutaminase; TGase or TG) という名前の酵素ファミリー(複数種の酵素群)によって行われます。この酵素反応の生理的な意義(何のために存在しているのか)についてはまだまだ未知な点が多く残されています。ここではその反応と分かっている機能(役割)について紹介します。

トランスグルタミナーゼの反応機構
タンパク質のグルタミンというアミノ酸残基に、リジン残基のアミノ基がペプチド結合によって結ばれます(架橋反応)。架橋される基質は同じ場合(分子内架橋)や異なる場合(タンパク質間架橋)があります。また、リジン残基だけでなく、
一級アミンもグルタミンに結合します。
しかし体の中で何の制限も無く、このようなことが起こっては大変です。
この反応には適切なカルシウムイオンが必要で、カルシウムによる立体構造の変化
(TG2)やプロテアーゼなどにより少し分解されて形が変わる(TG3, FXIII)など、厳密なコントロール(活性制御機構)が知られています。

アイソザイム
アイソザイムと言う言葉を知っていますか?
いわば酵素の「兄弟姉妹」のようなもので、触媒する反応形式は同じですが、
一次構造(アミノ酸配列)や存在する場所(組織分布)が異なるものをいいます。トランスグルタミナーゼはヒトの場合、8種類がこれまでに見つかっています。
それぞれは以下のように、分子量(大きさ)、存在部位、役割が異なります。
これらのアイソザイムは、Factor XIII (血液凝固第13因子)以外は発見順に背番号がついています。また、赤血球には、バンド4.2と呼ばれる、酵素活性はないものの、形のよく似たタンパク質が存在しています。ヒト、マウスの遺伝子が明らかにされており、これらのTGaseが研究対象としてよく用いられています。哺乳動物にはおそらく全て同じようなアイソザイムが存在すると考えられています。
(右の表はヒトのトランスグルタミナーゼファミリー)

血液凝固(Factor XIII) この酵素反応のおかげで血が固まる!
出血した時、血が固まってかさぶたになります。ここにトランスグルタミナーゼが働いています。 血液凝固は、血液の液体部分(血漿)の中にある、いくつかのタンパク質が形を変えて働き、最後の段階ではフィブリンと言うタンパク質が、重合化(たくさん集まること)して、不溶化します。フィブリンも初めはフィブリノーゲンという名前で溶けていますが、トロンビンと言う酵素で切断されて、これがトランスグルタミナーゼ(Factor XIII: 13番目に働くタンパク質なのでこう呼んでいます)によって架橋重合されます。
つまり、血液凝固の最後に登場して、血を固める。当然ながらこの酵素がおかしくなれば、様々な血液凝固傷害、流産(原因は不明)などが起こることが報告されています。

皮膚表皮形成(TG1, TG3, TG5, TG6?)
この酵素反応のおかげで丈夫な皮膚ができる!
普段は感じませんが、我々の皮膚は外界からの刺激、つまり紫外線や物理的な力、さらには病原菌にも対処できるような丈夫なバリアとして働いています。 皮膚の表面は細胞が生命活動をやめていて、細胞の中のタンパク質が細胞膜周辺に固まって存在しています。これを角化といいます。
トランスグルタミナーゼは、表皮細胞が、皮膚の奥からできあがるにつれて、細胞の中にあるタンパク質を架橋重合化して、細胞膜に集め、裏打ちして、物理的にも化学的にも強力なバリアを作ることに役立っています。
右図では表皮細胞内の様々なタンパク質(構造タンパク質といいます)が、架橋重合されています。

傷害の修復・細胞外マトリクスの強化・細胞死・死細胞の処理(TG2)
この酵素反応により傷が治り、死細胞が処理される!
細胞は傷つくこともあり、寿命もあり、また突然に死ぬことがあります。 こうした傷を受けた細胞の細胞膜を修復することにも役立っています。また、死んだ細胞からの漏出物が悪影響を及ぼさないように、細胞内のタンパク質など構成成分を架橋重合化して、漏れを防いでいます。 細胞よってはその周辺に、細胞外マトリクス(コラーゲン、フィブロネクチン)を分泌して、他細胞との周りを埋めています。これをさらに強化するということに働いています。また、肝障害時の細胞死誘導やマクロファージという死んだ細胞を食べて処理(貪食)する細胞の機能にも関わっています。
神経疾患、自己免疫疾患にも関わっている まだ研究が進行中ですが、様々な神経疾患(アルツハイマー病など)の原因にも、このタンパク質接着架橋が絡んでいるのではないかと言われていて、いくつかの報告があります。神経細胞内で異常に架橋形成が起こって、タンパク質が細胞の中で固まり(不溶性沈着物)となって、有害になるという説が上げられています。 また、欧米諸国では、この酵素の働きが小麦タンパク質にアレルゲンとしての性質を与える(セリアック病)ことが知られており、多くの患者がいます。
下等動物、植物や微生物にもこの酵素はある?
このタンパク質同士の架橋化反応やそれを司る酵素は、無脊椎動物、植物や微生物など幅広い生物で存在します。遺伝子構造が明らかにされているものもあります。微生物(放線菌)の産生する、トランスグルタミナーゼはとても活性が安定であり、現在は食品の粘弾性の強化のために使われています(味の素株式会社より、「アクティバ」の商品名で市場に出ています)。
無脊椎動物では、昆虫(バッタ、ショウジョウバエ)、カブトガニ、ウニ、微生物でも細菌類で遺伝子クローニングが完了して構造が明らかになっています。ところが、無脊椎動物のトランスグルタミナーゼは上にあげたヒトやマウスのものとよく似ているのですが、微生物になると全く構造が違います。植物はまだよくわかっていません。しかし、我々は、原生生物(動植物、菌類のいずれにも属さない)の粘菌(真正粘菌)のトランスグルタミナーゼ遺伝子の解析に成功して、これが極めて動物のタイプに近いものであるという驚くべき結果を得ました。
ショウジョウバエ、ゼブラフィッシュ、ウニなどの発生学、形態形成の研究のモデル動物にも、高等動物と同じような構造をしたトランスグルタミナーゼが存在しています。今、このような動物をモデルにして、遺伝子をノックダウン(転写されなくする)した変異動物が作製され、そこからタンパク質架橋反応の意義を見出す、という研究が行われつつあります。